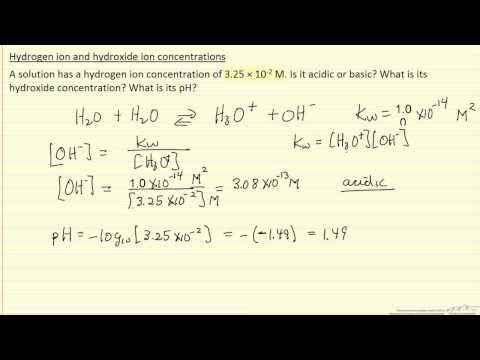
Vsebina

Ko se kislina ali baza raztopi v vodi, se disociira na ione. Kisline vodi donirajo vodikove ione in tvorijo hidronijeve ione (H3O +). Baze tvorijo hidroksidne ione (OH-). PH raztopine meri število raztopljenih vodikovih in hidroksidnih ionov. Lestvica pH se giblje med nič in 14 in je logaritemska, kar pomeni, da vsaka sprememba pH ustreza desetkratni spremembi ionske koncentracije.
Korak 1
Pomnožite pH raztopine z -1. Na primer, če ima raztopina pH 10,14: 10,14 × (-1) = -10,14.
2. korak
Dvignite vrednost na deseti stepen: 10 ^ (-10,14) = 7,244 × 10 ^ (- 11). To je koncentracija vodikovih ionov v raztopini v molih na liter.
3. korak
K odgovoru v koraku 1 dodajte 14: 14+ (-10,14) = 3,86. To je vrednost raztopine pOH.
4. korak
Pomnožite pOH z -1: 3,86 × (-1) = -3,86.
5. korak
Najdeno vrednost dvignite na deseti stepen: 10 ^ (- 3,86) = 1,38 × 10 ^ (- 4). To je koncentracija hidroksidnih ionov v raztopini v molih na liter.