Vsebina
- Število elektronov v valentni lupini
- Korak 1
- 2. korak
- 3. korak
- 4. korak
- Lewisova struktura
- Korak 1
- 2. korak
- 3. korak
- Formalni naboj vsakega atoma
- Korak 1
- 2. korak
- 3. korak
Pri določanju formalnega naboja molekule, kot je CoCl2 (plin fosgen), je treba poznati število elektronov v valentni plasti vsakega atoma in Lewisovo strukturo molekule.
Število elektronov v valentni lupini
Korak 1
V periodnem sistemu elementov poiščite vsak atom, da določite število elektronov v valentni lupini.
2. korak
Ne pozabite, da sta dva elektrona na prvi podnivo s, dva na drugi podnivo s, šest elektronov na prvi podnivo p itd. Ne pozabite: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
3. korak
Udari tovor. Če je molekula ion, dodajte ali odštejte enega ali več elektronov od skupnega, da pridete do končnega naboja.
4. korak
Za CoCl2 (fosgeni plin): C = 4; O = 6; Cl = 7. Molekula ni ionizirana in ima nevtralen naboj. Zato je skupno število elektronov v valentni lupini 4 + 6 + (7x2) = 24.
Lewisova struktura
Korak 1
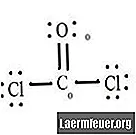
Glej diagram Lewisove strukture CoCl2 (plin fosgen). Lewisova struktura predstavlja najbolj stabilno in verjetno strukturo molekule. Atomi se vlečejo s seznanjenimi valentnimi elektroni; vezi se tvorijo med prostimi elektroni, da zadostijo pravilu okteta.
2. korak

Nariši vsak atom in njegove valentne elektrone in nato po potrebi tvori vezi.
3. korak
Kloridni atomi delijo enostavne vezi z molekulo ogljika, medtem ko atom kisika tvori dvojno vez z ogljikom. Vsak atom v končni strukturi izpolnjuje pravilo okteta in ima osem elektronov v valentni lupini, kar omogoča molekularno stabilnost.
Formalni naboj vsakega atoma
Korak 1
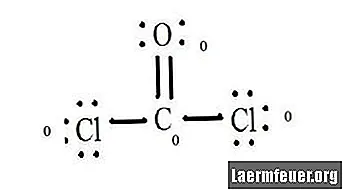
Preštejte pare brez elektronov vsakega atoma v Lewisovi strukturi. Vsakemu atomu je dodeljen elektron iz vsake vezi, v kateri sodeluje. Dodajte te številke. V CoCl2: C = 0 prostih parov plus 4 elektroni vezi = 4 elektroni. O = 4 elektroni prostih parov plus 2 elektrona vezi = 6 elektronov. Cl = 6 elektronov prostih parov plus en elektron vezi s C = 7 elektroni.
2. korak
Odštejte količino števila elektronov v valentni lupini v nevezanem atomu. Rezultat je formalni naboj za vsak atom. V CoCl2: C = 4 valenčni elektroni (ev) v nevezanem atomu minus 4 elektroni, označeni v Lewisovi strukturi (LS) = 0 formalni naboj O = 6 ev - 6 LS = 0 formalni naboj Cl = 7 ev - 7 LS = 0 formalni tovor
3. korak
Med pisanjem postavite te naboje blizu atomov v Lewisovi strukturi. Če ima molekula naboj v celoti, Lewisovo strukturo postavite v oklepaje, naboj pa je napisan na zunanji strani v zgornji desni kot.