Vsebina
- Navodila
- Število elektronov v valenčni plasti
- Lewisova struktura
- Formalni naboj vsakega atoma
- Obvestilo
- Kaj potrebujete
Pri določanju formalnega naboja molekule, kot je CoCl2 (plin fosgen), je treba poznati število elektronov v valentni plasti vsakega atoma in Lewisovo strukturo molekule.
Navodila
-
Poiščite vsak atom v periodni tabeli elementov, da določite število elektronov v valenčni plasti.
-
Spomnimo se, da sta v prvem pod-nivoju dva elektrona, dva v drugem pod-nivoju s, šest elektronov v prvem podravni p in tako naprej. Odpoklic: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Zadeti obremenitev. Če je molekula ion, dodajte ali odštejte enega ali več elektronov iz celotne količine, da dosežete končno polnjenje.
-
Za CoCl2 (plin fosgen): C = 4; O = 6; Cl = 7. Molekula ni ionizirana in ima nevtralni naboj. Zato je skupno število elektronov v valenčni plasti 4 + 6 + (7x2) = 24.
Število elektronov v valenčni plasti
-
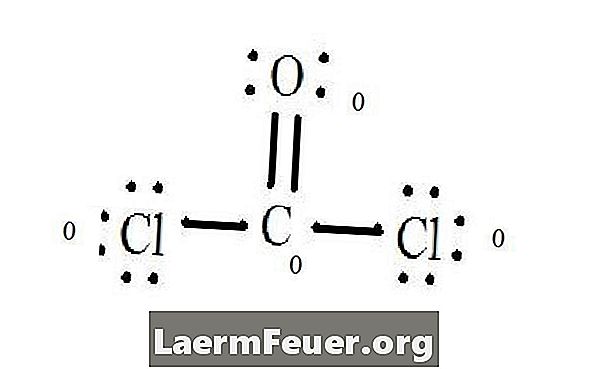
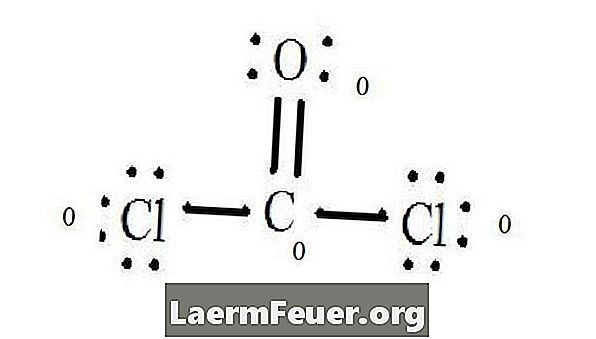
Glej Lewisovo diagram strukture CoCl2 (plin fosgen). Lewisova struktura predstavlja najbolj stabilno in verjetno strukturo molekule. Atomi se vlečejo s parnimi valenčnimi elektroni; Med prostimi elektroni nastajajo vezi, ki zadostujejo oktetnemu pravilu.
-
Narišite vsak atom in njegove valenčne elektrone in nato po potrebi formirajte vezi.
Elektroni, narisani na Lewisovi strukturi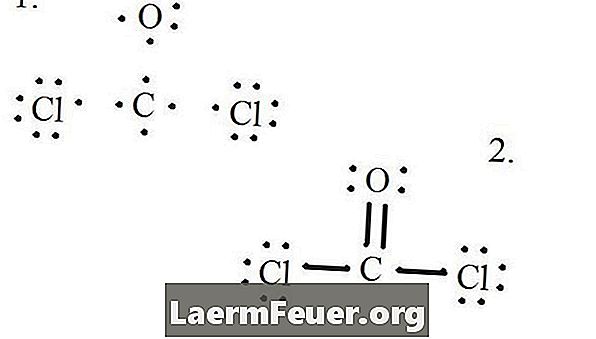
-
Atomi klorida delijo posamezne vezi z molekulami ogljika, medtem ko atom kisika tvori dvojno vez z ogljikom. Vsak atom v končni strukturi ustreza oktetnemu pravilu in ima osem elektronov v valenčni plasti, ki omogoča molekularno stabilnost.
Lewisova struktura
-
Preštejte pare prostih elektronov vsakega atoma v Lewisovi strukturi. Vsak atom označuje elektron vsake vezi, iz katere sodeluje. Dodajte te številke. V CoCl2: C = 0 prostih parov in 4 vezni elektroni = 4 elektrona. O = 4 elektroni prostih parov in 2 elektronov vezi = 6 elektronov. Cl = 6 elektronov prostih parov in en elektron ene vezi s C = 7 elektronov.
-
Odštejte količino števila elektronov v valentni plasti na nevezanem atomu. Rezultat je formalni naboj za vsak atom. V CoCl2: C = 4 valenčnih elektronov (ev) v nevezanem atomu minus 4 elektronov, označenih v Lewisovi strukturi (LS) = 0 formalni naboj O = 6 ev - 6 LS = 0 formalni naboj Cl = 7 in - 7 LS = 0 formalna dajatev
Formalne naboje atomov
-
Pri pisanju postavite te naboje blizu atomov v Lewisovi strukturi. Če ima celotna molekula naboj, postavite Lewisovo strukturo v oklepaje z nabojem, napisanim na zunanji strani v zgornjem desnem kotu.
Formalni naboj vsakega atoma
Obvestilo
- Izračun formalnega naboja za molekule, ki vsebujejo prehodne kovine, je lahko izdajat. Število elektronov v valenčni plasti za prehodne kovine bodo tiste iz vzorca žlahtnih plinov.
Kaj potrebujete
- Periodni sistem elementov